Tout savoir sur la conception, le développement et le mécanisme d’action de HEMGENIX®.
Preuves cliniques
HEMGENIX®, première et seule thérapie génique approuvée par l'EMA contre l'hémophilie B, traite la cause première de la maladie et réduit son impact sur les patients.1,2 La grande efficacité de HEMGENIX® a été démontrée lors de l’essai pionnier HOPE-B de phase 3, le plus grand essai à ce jour portant sur une thérapie génique dans l’hémophilie B.1,3,4

Efficacité grâce à une perfusion unique
HEMGENIX® aide les personnes atteintes d'hémophilie B à accéder à un nouveau degré de liberté : une perfusion unique peut offrir à un large éventail de patients une protection de longue durée contre les saignements et un taux de facteur IX durablement proche de la normale.1,3
Libération de la prophylaxie de routine
96 % des patients ont arrêté la prophylaxie de routine par facteur IX et n’ont pas eu besoin d’une prophylaxie jusqu’à 24 mois après l’administration de HEMGENIX®.1
52 des 54 patients n’ont pas eu besoin de la prophylaxie de routine continue par facteur IX antérieure jusqu’aux mois 18 à 24 après le traitement. 2 patients n’ont pas répondu au traitement par HEMGENIX® : 1 patient n’a reçu que 10 % de la dose prévue et 1 patient n’a pas répondu au traitement (titre d’anticorps neutralisants anti-AAV5 préexistants de 1:4417).1
Protection de longue durée contre les saignements
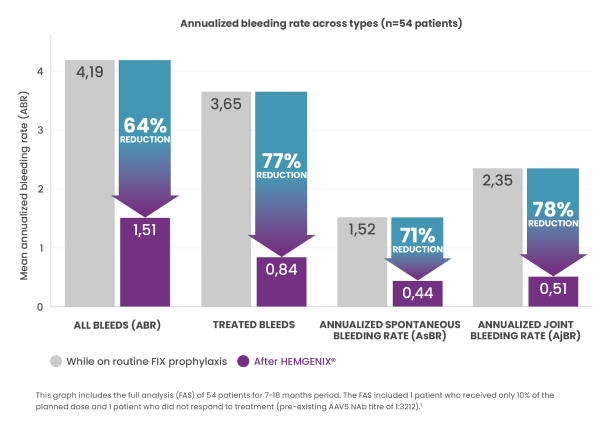
Réduction de 64 % du taux de saignements annualisés (ABR), par rapport à la prophylaxie bien menée au cours de la période initiale. Tous les taux de saignements mesurés ont diminué à la suite du traitement par HEMGENIX®.1,3
Le ABR pour tous les types de saignements après une expression stable du facteur IX est tombé d’une moyenne de 4,19 pendant la période initiale (tous les patients étaient sous prophylaxie bien menée) à une moyenne de 1,51 (p = 0,0002) au cours des 7 à 18 mois après l’administration.1
Activité élevée et soutenue du facteur IX
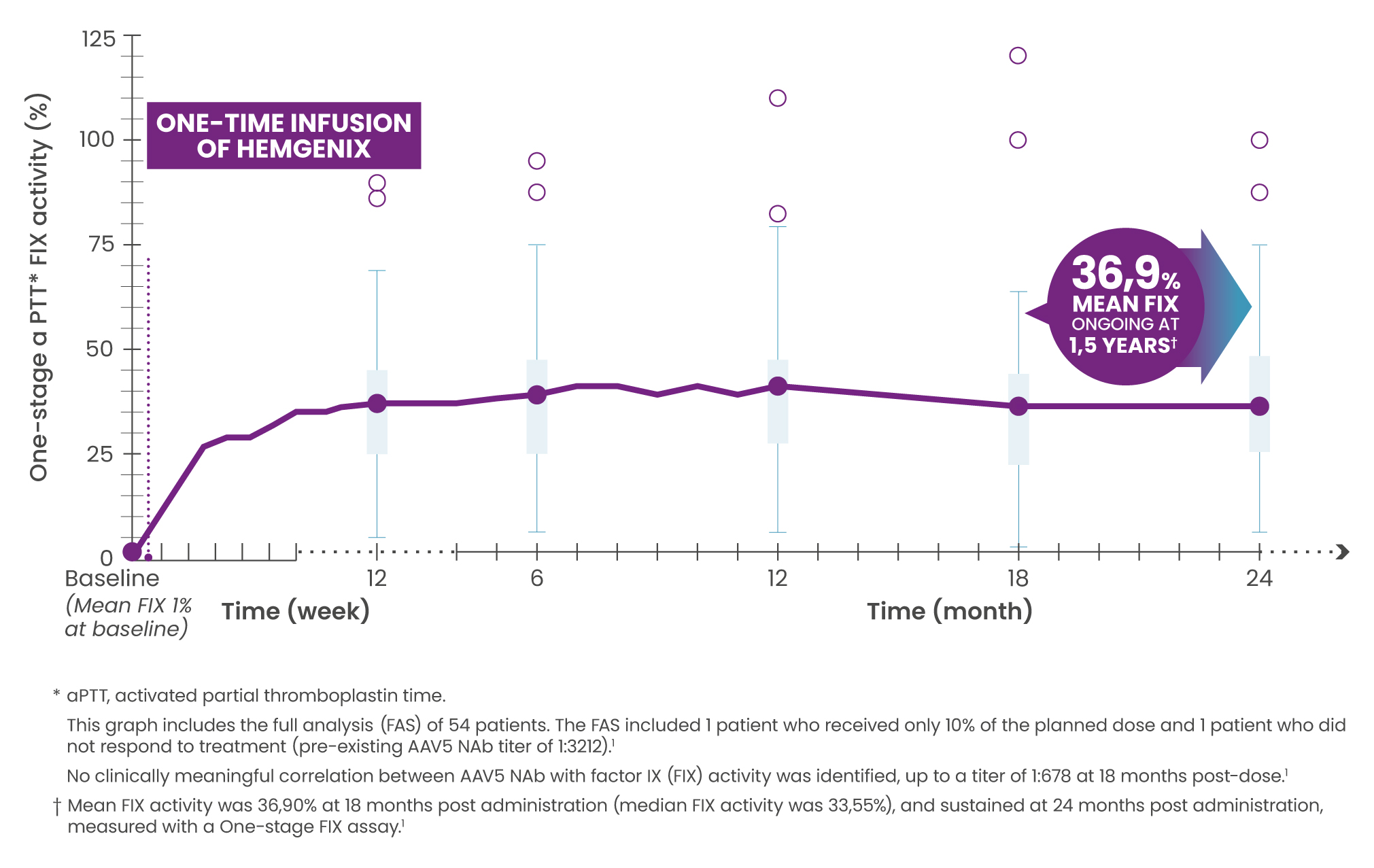
36,90 % d’activité moyenne du facteur IX à 1,5 an après la perfusion, maintenus 2 ans après la perfusion.1
L’activité moyenne du facteur IX (n = 50) était de 36,90 % (écart type 21,40) à 18 mois après l’administration (l’activité médiane du facteur IX était de 33,55 %) et était maintenue à 24 mois après l’administration ; activité du facteur IX mesurée à l’aide du dosage en un temps du facteur IX.1
Durabilité à long terme
Après une perfusion unique de hemgenix®, l’activité moyenne du facteur IX (n = 50) était de 36,90 % (écart type 21,40) à 1,5 an et était maintenue 2 ans après l’administration.1
Les taux de facteur IX dans la plage faible à normal étaient maintenus à 2,5 ans lors d’une étude de phase 2b en cours utilisant HEMGENIX® (n = 3). 5

Activité élevée et
soutenue du
facteur IX
L’activité moyenne du facteur IX (n = 50) était de 36,90 % (écart type 21,40) à 18 mois après l’administration (l’activité médiane du facteur IX était de 33,55 %) et était maintenue à 24 mois après l’administration ; activité du facteur IX mesurée à l’aide du dosage en un temps du facteur IX.1
Taux de succès
élevé
100 % des patients (n = 52) ayant répondu au traitement par HEMGENIX® ont arrêté la prophylaxie de routine par facteur IX et n’ont pas eu besoin d’une prophylaxie jusqu’à 24 mois après l’administration de HEMGENIX®.1
52 des 54 patients n’ont pas eu besoin de la prophylaxie de routine continue par facteur IX antérieure jusqu’au mois 24 après le traitement. 2 patients n’ont pas répondu au traitement par HEMGENIX® : 1 patient n’a reçu que 10 % de la dose prévue et 1 patient n’a pas répondu au traitement (titre d’anticorps neutralisants anti-AAV5 préexistants de 1:4417).1
Des résultats qui
changent la vie
Les patients ont connu une amélioration statistiquement significative de la qualité de vie générale (p =< 0,0001), ainsi que dans les domaines des sentiments (p =< 0,0001), du traitement (p =< 0,0001), du travail/de l’école (p = 0,0036) et de l’avenir (p = 0,0023).3
Profil de sécurité
Durant l’essai clinique pivot de phase 3, HEMGENIX® s’est avéré efficace et montrait un profil de sécurité favorable, aucun effet indésirable grave lié au traitement et aucun cas de développement d’inhibiteurs du facteur IX n’a été rapporté.*,1
* Pour la liste complète des effets indésirables, veuillez consulter le résumé des caractéristiques du produit.
Effets indésirables
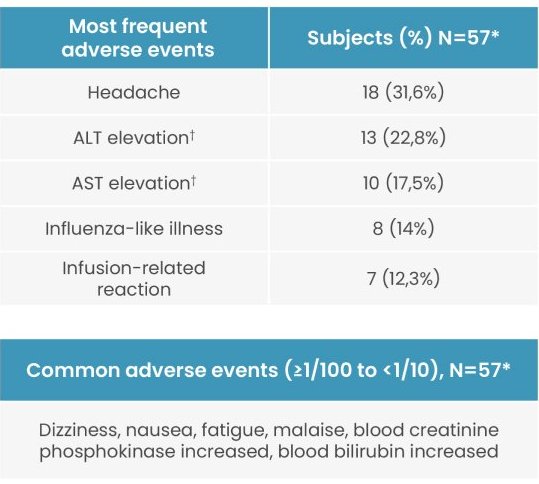
Les effets indésirables liés au traitement les plus fréquents étaient des réactions légères3 liées à la perfusion, chez 7 patients sur 54 (12,3 %), y compris des réactions d’hypersensibilité et d’anaphylaxie, la majorité étant légères et disparaissant le jour même.1
En cas de réaction liée à la perfusion survenant pendant l’administration, la perfusion peut être ralentie ou arrêtée temporairement puis redémarrée à un débit plus lent une fois que la réaction a disparu.1
Élévation transitoire des enzymes hépatiques
Aucune des élévations du taux d’ALT liées au traitement n’était grave et toutes se sont normalisées après une corticothérapie de courte durée. Au cours des trois premiers mois suivant l’administration de HEMGENIX®, les patients doivent être soumis à une surveillance hebdomadaire afin de détecter toute élévation des enzymes hépatiques.1
Lors des études cliniques de phase 2b et de phase 3 (HOPE-B), une élévation du taux d’ALT a été observée chez 13 patients sur 57 (22,8 %). Neuf des 13 patients présentant une élévation du taux d’ALT ont reçu une corticothérapie avec réduction progressive de la dose. La durée moyenne de la corticothérapie à la suite d’une élévation du taux d’ALT était de 81,4 jours. Aucune des élévations du taux d’ALT liées au traitement n’était grave et toutes se sont normalisées en 3 à 127 jours. Des stéroïdes en prophylaxie afin de prévenir une élévation du taux d’ALT n’ont pas été nécessaires.1
QUESTIONS FRÉQUENTES
Références
- CSL Behring. SPC Hemgenix® (12/2024)
- CSL Behring. First Gene Therapy for Hemophilia B, CSL's HEMGENIX®, Approved by the European Commission. Press release. 20 Feb 2023. Available at: https://newsroom.csl.com/2023-02-20-First-Gene-Therapy-for-Hemophilia-B,-CSLs-HEMGENIX-R-,-Approved-by-the-European-Commission. Accessed March 2023.
- Pipe SW, et al. Gene Therapy with Etranacogene Dezaparvovec for Hemophilia B. N Engl J Med. 2023;388:706-718.
- CSL Behring. Final Analysis of Pivotal HOPE-B Study Demonstrates Durable and Sustained Therapeutic Effect ofEtranacogene Dezaparvovec Gene Therapy in Hemophilia B – Data Presented at EAHAD 2022. Press release. 04 Feb 2022. Available at: https://www.cslbehring.com/newsroom/2022/hope-b-data-presented-at-eahad2022. Accessed October 2022.
- von Drygalski A, Gomez E, Giermasz A, et al. Stable and durable factor IX levels in hemophilia B patients over 3 years post etranacogene dezaparvovec gene therapy. Blood Adv 2022; doi: https://doi.org/10.1182/bloodadvances.2022008886.
- Kruzik A, et al. Prevalence of Anti-Adeno-Associated Virus Immune Responses in International Cohorts of Healthy Donors. Mol Ther Methods Clin Devel. 2019;14:126-33.
- Miesbach W, Leebeek FWG, Recht M, et al. Final analysis from the pivotal phase 3 HOPE-B gene therapy trial: stable steady-state efficacy and safety of tranacogene dezaparvovec in adults with severe or moderately severe haemophilia B. Presented at: European Association for Haemophilia and Allied Disorders; February 2022; Virtual.
- Klamroth R, et al. Global Seroprevalence of Pre-existing Immunity Against AAV5 and Other AAV Serotypes in People with Hemophilia A. Hum Gene Ther. 2022;33(7-8):432-441.
- Falese L, et al. Strategy to detect pre-existing immunity to AAV gene therapy. Gene Ther. 2017;24(12):768-78.