Retour à la page d’accueil pour consulter l’aperçu du traitement par HEMGENIX®
À propos de HEMGENIX®
HEMGENIX® est une thérapie génique pionnière qui libère un large éventail de patients atteints d’hémophilie B de la prophylaxie de routine. Il peut offrir une protection de longue durée contre les saignements et un taux de facteur IX durablement proche de la normale, grâce à une perfusion unique.1,2

HEMGENIX®, première et seule thérapie génique approuvée par l’EMA contre l’hémophilie B, traite la cause première de la maladie et réduit son impact sur les patients.3
HEMGENIX® utilise un vecteur dérivé d’un virus adéno-associé de sérotype 5 (AAV5) recombinant non réplicatif, qui introduit un gène Padua thérapeutique du facteur IX ciblant le foie.1 Ce variant Padua extrêmement actif de la protéine du facteur IX s’est avéré engendrer une activité moyenne du facteur IX endogène 5 à 8 fois supérieure par rapport au facteur IX de type sauvage plus courant.4,5,6
Libération de la prophylaxie de routine1,2*
96,3%
des patients ont arrêté la prophylaxie de routine par facteur IX et n’ont eu besoin d’aucune prophylaxie1,*
-64%
du taux de saignements annualisés (ABR), par rapport à la prophylaxie bien menée au cours de la période initiale1,**
36,9%
d’activité moyenne du facteur IX à 1,5 an après la perfusion, maintenus 2 ans après la perfusion1,†

Profil de sécurité favorable1,‡
* Dans l’étude pivot de phase 3 en cours évaluant HEMGENIX® (HOPE-B), 52 des 54 patients traités n’ont pas eu besoin de la prophylaxie de routine continue antérieure par facteur IX au cours des 24 mois suivant le traitement. 2 patients n’ont pas répondu au traitement par HEMGENIX® : 1 patient n’a reçu que 10 % de la dose prévue et 1 patient n’a pas répondu au traitement (titre d’anticorps neutralisants anti-AAV5 préexistants de 1:4417). Un titre d’anticorps neutralisants anti-AAV préexistants supérieur à 1:898 peut gêner l’expression du transgène au niveau thérapeutique désiré et donc réduire l’efficacité du traitement par HEMGENIX®.1
** Le ABR pour tous les types de saignements après une expression stable du facteur IX est tombé d’une moyenne de 4,19 pendant la période initiale (tous les patients étaient sous prophylaxie bien menée) à une moyenne de 1,51 (p unilatéral = 0,0002) au cours des 7 à 18 mois après l’administration.1
† Activité moyenne du facteur IX (n = 50) de 36,90 % (écart type 21,40) à 18 mois après l’administration et de 36,66 % (écart type 18,96) à 24 mois après l’administration, activité médiane du facteur IX de 34 % (n = 50) maintenue à 18 et 24 mois après l’administration, activité du facteur IX mesurée à l’aide du dosage en un temps du facteur IX.1
‡ Pour la liste complète des effets indésirables, veuillez consulter le résumé des caractéristiques du produit.1
La thérapie génique dans l’hémophilie
L'hémophilie A et l'hémophilie B sont deux troubles génétiques monogéniques liés au chromosome X qui se prêtent à la thérapie génique.2,7La thérapie génique contre l’hémophilie a pour but d’augmenter le taux du facteur de coagulation VIII (hémophilie A) ou IX (hémophilie B), en introduisant un nouveau gène fonctionnel ou une nouvelle séquence codante afin d’améliorer la santé et de réduire ou d’éliminer la nécessité d’une prophylaxie de routine par facteur de coagulation.2,8,9
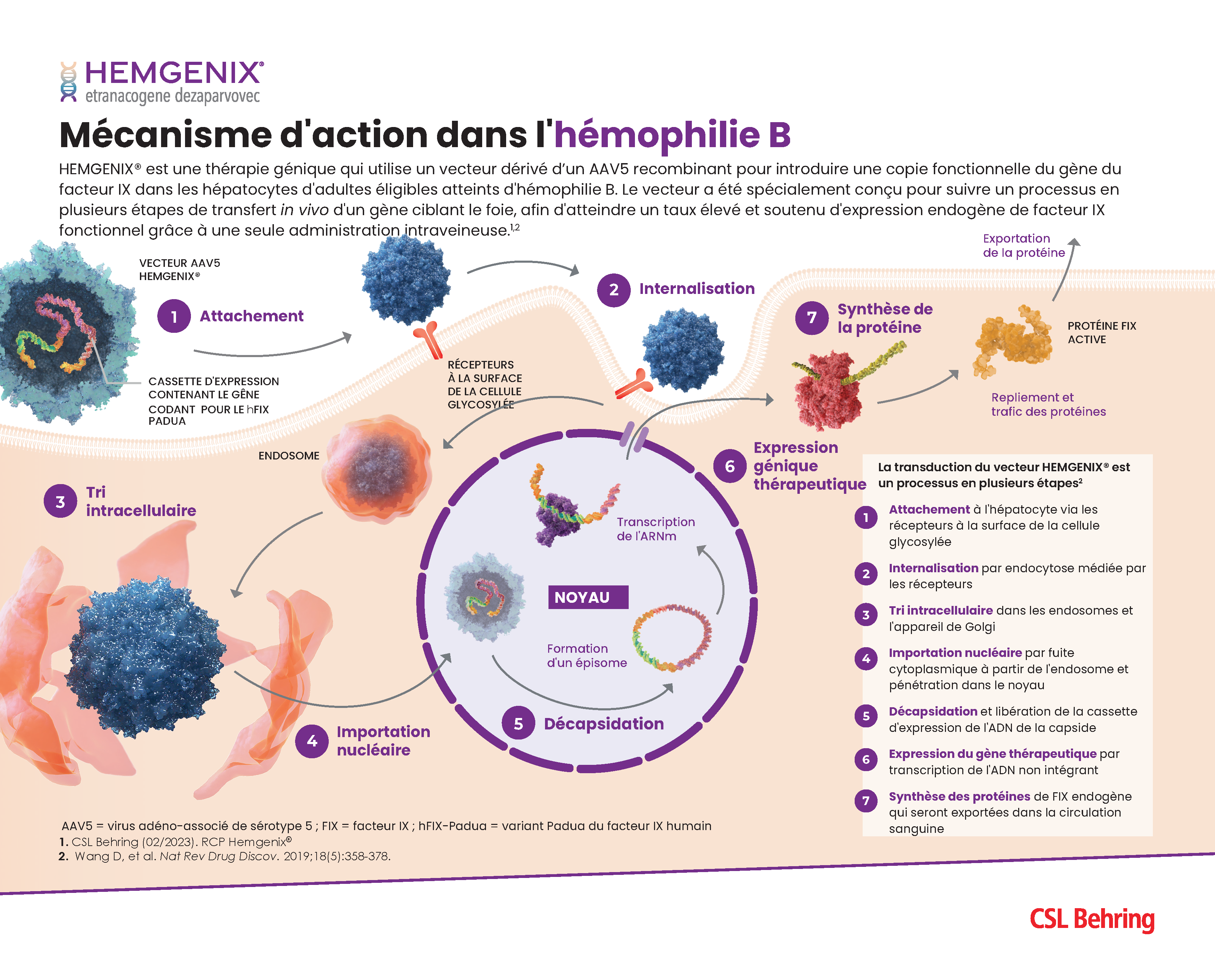
Infographie du mécanisme d’action de la thérapie génique
Cette infographie sur le mécanisme d’action présente la thérapie génique contre l’hémophilie décomposée en 7 étapes, depuis l’attachement du vecteur AAV jusqu’à la synthèse de la protéine du facteur de coagulation.
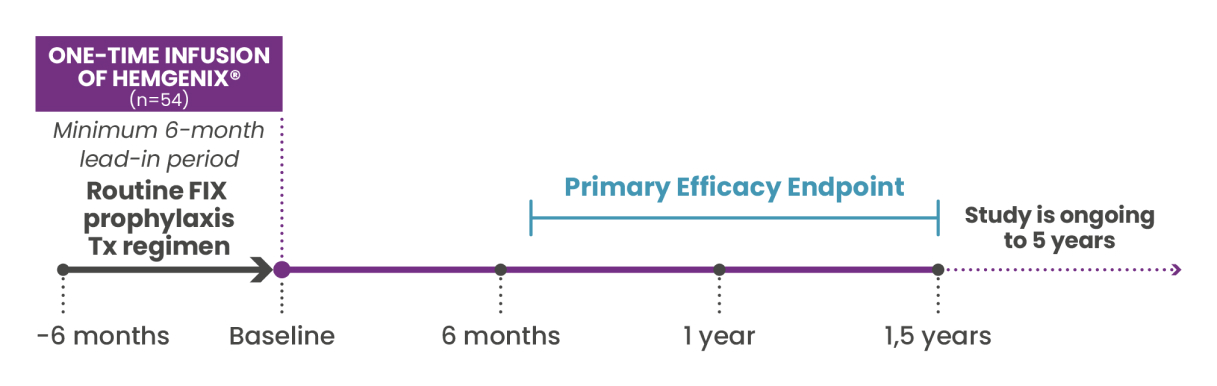
HOPE-B : un essai pionnier de phase 3
Le profil solide d'efficacité, de sécurité et de tolérance de HEMGENIX® a été démontré lors de l'essai pivot multinational HOPE-B de phase 3.1,10
HOPE-B a inclus 54 patients de sexe masculin, âgés d'au moins 18 ans et atteints d'hémophilie B congénitale (activité du facteur IX ≤ 2 % de la normale), sous prophylaxie continue par facteur IX depuis au moins 2 mois avant la sélection.1,2
Critère d’évaluation principal :1,2
Comparaison du taux de saignements annualisés (ABR) pour tous les saignements, entre HEMGENIX® et la prophylaxie, pour la non-infériorité entre la période initiale de 6 mois et les 52 semaines suivant l’expression stable du facteur IX (mois 7-18).
Critères d’évaluation secondaires clés :1,2
- Activité du facteur IX à 6, 12 et 18 mois après l’administration
- Proportion de patients n’ayant pas besoin d’une prophylaxie continue
- Survenue et résolution des saignements dans les articulations cibles et proportion de patients sans saignements
- Corrélation entre le taux d’activité du facteur IX et le titre d’anticorps neutralisants anti-AAV5 préexistants
- Effets indésirables
Le critère d’évaluation principal a été atteint, avec des données de patients évaluées pour les 24 premiers mois suivant le traitement par HEMGENIX®. Le suivi des patients continuera pendant 5 ans après l'administration de HEMGENIX®.1,2
Références
- CSL Behring. SPC Hemgenix® (12/2024)
- Pipe SW, et al. Gene Therapy with Etranacogene Dezaparvovec for Hemophilia B. N Engl J Med. 2023;388:706-718.
- CSL Behring. First Gene Therapy for Hemophilia B, CSL's HEMGENIX®, Approved by the European Commission. Press release. 20 Feb 2023. Available at: https://newsroom.csl.com/2023-02-20-First-Gene-Therapy-for-Hemophilia-B,-CSLs-HEMGENIX-R-,-Approved-by-the-European-Commission. Accessed March 2023.
- Nathwani AC. Gene therapy for Haemophilia. Hematology Am Soc Hematol Educ Program. 2019;2019(1):1-8.
- Thornburg CD. Etranacogene dezaparvovec for hemophilia B gene therapy. Ther Adv Rare Dis. 2021;2:1–14.
- Von Drygalski A, et al. Etranacogene dezaparvovec (AMT-061 phase 2b): normal/near normal FIX activity and bleed cessation in hemophilia B Blood Advances. 2019;3(21):3241-47.
- Rodríguez-Merchán EC, et al. Gene Therapy in Hemophilia: Recent Advances. Int. J. Mol. Sci. 2021;22:7647-67.
- Miesbach W, et al. Gene therapy with adeno-associated virus vector 5–human factor IX in adults with hemophilia B. Blood. 2018;131(9):1022-31.
- Perrin GQ, Herzog RW, Markusic DM. Update on clinical gene therapy for Haemophilia. Blood. 2019;133(5):407-414.