Ga terug naar de Startpagina voor het overzicht van de HEMGENIX®-therapie
Over HEMGENIX®
HEMGENIX® is een baanbrekende gentherapie die een groot aantal hemofilie B-patiënten vrijstelt van routinematige profylaxe. Een eenmalige infusie biedt langdurige bescherming tegen bloedingen en langdurige bijna normale FIX-spiegels.1,2

HEMGENIX® is de eerste en enige door het EMA goedgekeurde gentherapie voor hemofilie B die de onderliggende oorzaak van hemofilie B aanpakt en de gevolgen ervan voor de patiënt vermindert.3
HEMGENIX® gebruikt de niet-replicerende, recombinante adeno-geassocieerde virus 5-vector (AAV5) voor de op de lever gerichte introductie van een therapeutisch FIX-Padua-gen.1 Deze zeer actieve FIX-Padua-eiwitvariant genereert een 5 tot 8 keer hogere gemiddelde endogene FIX-activiteit dan het meer gebruikelijke wildtype FIX-eiwit.4,5,6
Vrijgesteld van routinematige profylaxe1,2*
96,3%
van de patiënten stopte met routinematige FIX-profylaxe en bleef vrijgesteld van profylaxe1,*
-64%
vermindering van het aantal bloedingen op jaarbasis (annualized bleeding rate, ABR) vs. goed uitgevoerde profylaxe in de aanloopperiode1,**
36,9%
gemiddelde FIX-activiteit na 1,5 jaar en aanhoudend 2 jaar na infusie1,†

Gunstig veiligheidsprofiel1,‡
* In de lopende HEMGENIX® fase 3-hoofdstudie (HOPE-B) bleven 52 van de 54 behandelde patiënten vrijgesteld van eerdere continue routinematige FIX-profylaxe tot en met 24 maanden na behandeling. Twee patiënten reageerden niet op de behandeling met HEMGENIX®: 1 patiënt kreeg slechts 10% van de geplande dosis en 1 patiënt reageerde niet op de behandeling (reeds bestaande AAV5 NAb-titer van 1:4417). Reeds bestaande neutraliserende anti-AAV-antilichamen boven een titer van 1:898 kunnen de expressie van het transgen op het gewenste therapeutische niveau belemmeren en zo de werkzaamheid van de HEMGENIX®-therapie verminderen.1
** De ABR voor alle types bloedingen na stabiele FIX-expressie daalde van een gemiddelde van 4,19 voor de aanloopperiode (alle patiënten hadden een goed uitgevoerde profylaxe) naar een gemiddelde van 1,51 (1-zijdig p=0,0002) in de maanden 7 tot 18 na de dosis.1
† Gemiddelde FIX-activiteit (n=50) op 36,90 (SD 21,40) 18 maanden na toediening en op 36,66 (SD 18,96) 24 maanden na toediening, 34% mediane FIX-activiteit (n=50) behouden op 18 en 24 maanden na toediening, FIX-activiteit gemeten met een FIX-eenstapstest.1
‡ Raadpleeg voor een volledige lijst van bijwerkingen de Samenvatting van de productkenmerken.1
Gentherapie voor hemofilie uitgelegd
Hemofilie A en B zijn beide monogene, X-gebonden genetische aandoeningen die geschikt zijn voor gentherapie.2,7 Gentherapie voor hemofilie A en B is gericht op het verhogen van de stollingsfactor VIII-spiegels (hemofilie A) of factor IX-spiegels (hemofilie B) door een nieuw functioneel gen of nieuwe coderende sequentie te leveren. Dat resulteert in verbeterde gezondheidsresultaten en het verminderen of elimineren van de noodzaak van routinematige factorprofylaxe.2,8,9
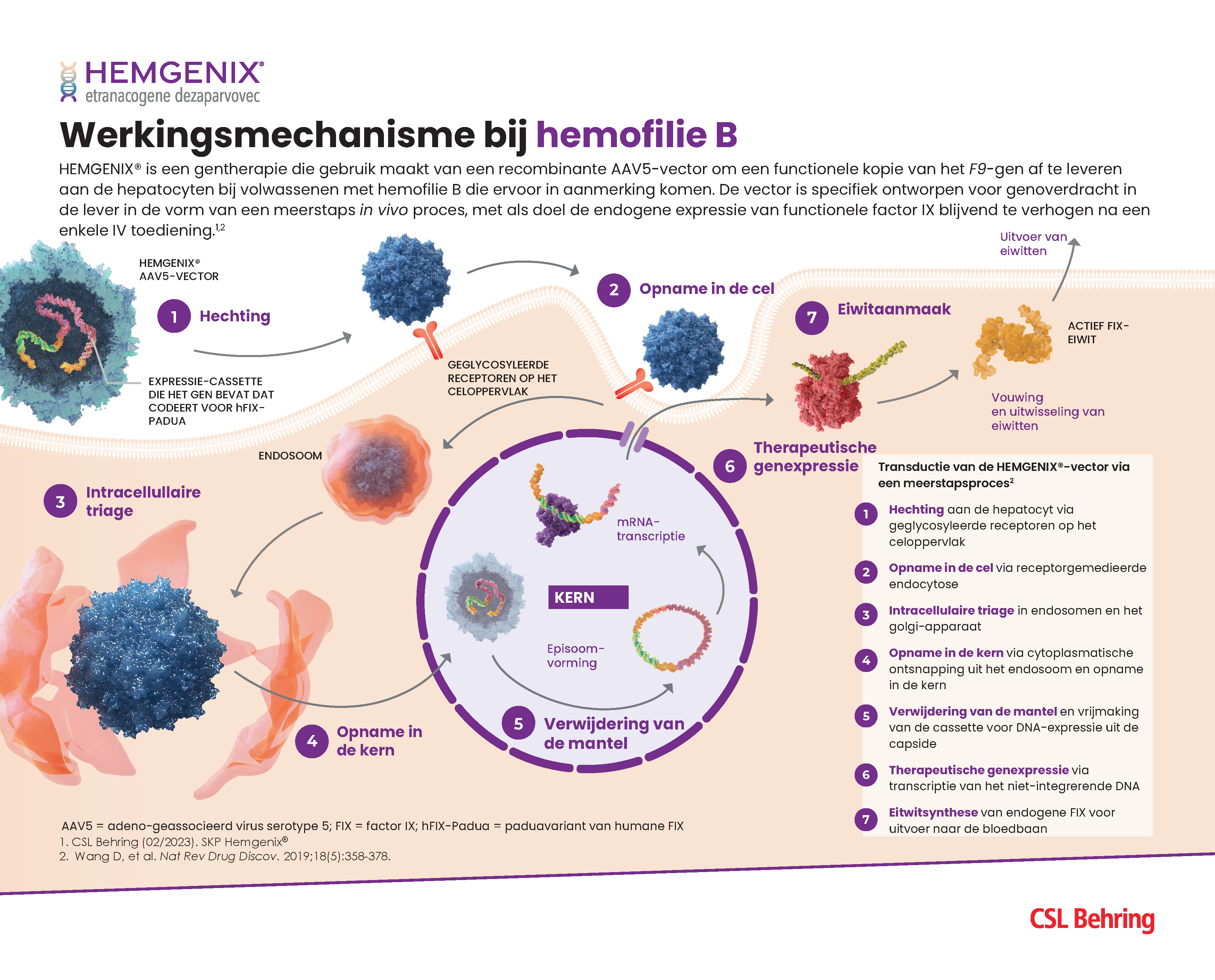
Werkingsmechanisme van gentherapie: infographic
Bekijk de gentherapie voor hemofilie in 7 stappen in deze infographic over het werkingsmechanisme, van AAV-vectorhechting tot eiwitsynthese van stollingsfactoren.
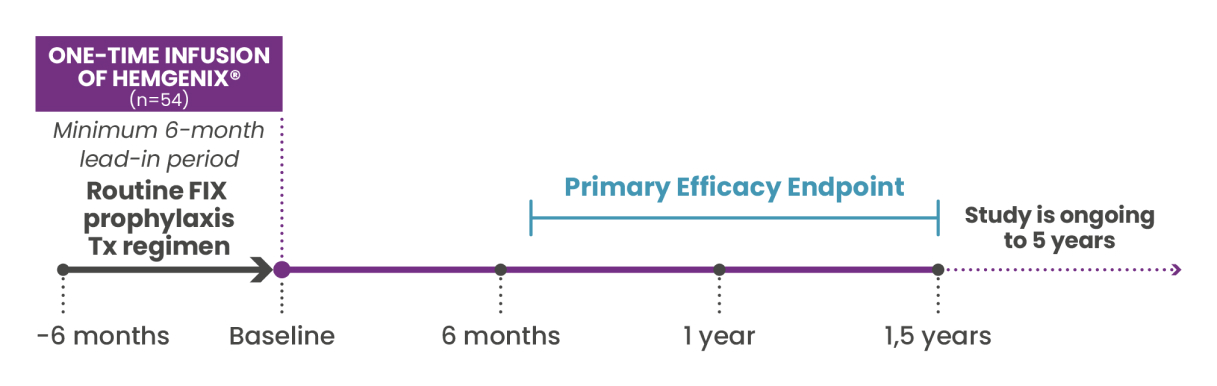
HOPE-B: een baanbrekende fase 3-studie
Het robuuste werkzaamheids-, veiligheids- en verdraagbaarheidsprofiel van HEMGENIX® werd aangetoond in HOPE-B, een multinationale fase 3-hoofdstudie.1,10
Aan HOPE-B namen 54 mannelijke patiënten ≥ 18 jaar deel met aangeboren hemofilie B (FIX-activiteit ≤ 2% van normaal), die vóór de screening gedurende ≥ 2 maanden continu FIX-profylaxe kregen.1,2
Primair eindpunt:1,2
Vergelijking van het aantal bloedingen op jaarbasis (ABR voor alle bloedingen), tussen HEMGENIX® en profylaxe voor non-inferioriteit, tussen de aanloopperiode van 6 maanden en de 52 weken na stabiele FIX-expressie (maand 7-18).
Belangrijkste secundaire eindpunten:1,2
- FIX-activiteit op 6, 12 en 18 maanden na toediening
- Aandeel patiënten dat vrijgesteld blijft van continue profylaxe
- Optreden en genezen van doelgewrichten en aandeel patiënten zonder bloedingen
- Correlatie van FIX-activiteitsniveaus met voorafbestaande AAV5 NAb-titer
- Bijwerkingen
Het primaire eindpunt is voltooid en de patiëntgegevens van de eerste 24 maanden na de behandeling met HEMGENIX® zijn geëvalueerd. De patiënten worden nog 5 jaar na de toediening van HEMGENIX® opgevolgd.1,2
Referenties
- CSL Behring. SPC Hemgenix® (12/2024)
- Pipe SW, et al. Gene Therapy with Etranacogene Dezaparvovec for Hemophilia B. N Engl J Med. 2023;388:706-718.
- CSL Behring. First Gene Therapy for Hemophilia B, CSL's HEMGENIX®, Approved by the European Commission. Press release. 20 Feb 2023. Available at: https://newsroom.csl.com/2023-02-20-First-Gene-Therapy-for-Hemophilia-B,-CSLs-HEMGENIX-R-,-Approved-by-the-European-Commission. Accessed March 2023.
- Nathwani AC. Gene therapy for Haemophilia. Hematology Am Soc Hematol Educ Program. 2019;2019(1):1-8.
- Thornburg CD. Etranacogene dezaparvovec for hemophilia B gene therapy. Ther Adv Rare Dis. 2021;2:1–14.
- Von Drygalski A, et al. Etranacogene dezaparvovec (AMT-061 phase 2b): normal/near normal FIX activity and bleed cessation in hemophilia B Blood Advances. 2019;3(21):3241-47.
- Rodríguez-Merchán EC, et al. Gene Therapy in Hemophilia: Recent Advances. Int. J. Mol. Sci. 2021;22:7647-67.
- Miesbach W, et al. Gene therapy with adeno-associated virus vector 5–human factor IX in adults with hemophilia B. Blood. 2018;131(9):1022-31.
- Perrin GQ, Herzog RW, Markusic DM. Update on clinical gene therapy for Haemophilia. Blood. 2019;133(5):407-414.